Der pH-Wert bei Reinigungsmitteln
Wenn man beurteilen möchte, wozu einzelne Reinigungsmittel geeignet sind und wozu nicht, ist der pH-Wert eine der wichtigsten Informationen. Denn bei Reinigungsmitteln kann man am pH-Wert erkennen, ob sich der Reiniger z.B. für die Entfernung von Kalkablagerungen oder für die Entfettung von öligen Oberflächen eignet. Auch erkennt man am pH-Wert des Reinigers, wie „scharf“ bzw. stark der Reiniger sauer oder alkalisch ist. Damit erkennt man auch die Gefährlichkeit bei Hautkontakt. Aber der Reihe nach:
Der pH-Wert – Versuch einer „einfachen“ Erklärung
Zur Erläuterung des pH-Wertes findet man viele komplizierte Beschreibungen, die für Nicht-Chemiker nur schwer nachvollziehbar sind. Wir versuchen hier eine hoffentlich verständlichere Beschreibung, die dem Zweck dient, den pH-Wert von Reinigungsmitteln sachgerecht einzuschätzen.
Zunächst ist festzuhalten, dass es für den pH-Wert keine Einheiten gibt. Anders als bei Gewichten, die man beispielsweise in Kilogramm angibt, Längen, die man z.B. in Metern angibt oder Geschwindigkeit, die man in Strecke pro Zeit also z.B. in Kilometer pro Stunde (km/h) angeben kann, hat der pH-Wert keine solche Einheit.
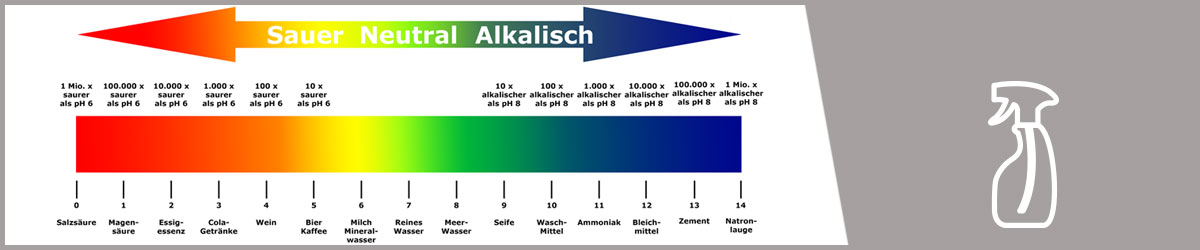
Der niedrigste Wert ist der Wert 0 für extrem ätzende Säuren. Der Höchste Wert ist der Wert 14 für extrem ätzende Laugen. In der Mitte liegt der pH-Wert 7, den man als neutral bezeichnet.
Wenn man sich nun von dieser neutralen Mitte Stück für Stück in die saure Richtung bewegt, wird die Säure immer stärker. Das heißt, Säure ist nicht gleich Säure. Es gibt schwache Säuren und stark ätzende Säuren. Wichtig ist, dass nicht der Säuregehalt einer Lösung entscheidend ist, sondern die „Kraft“, mit der eine Säure in der Lösung wirken kann. Wenn Sie lesen, dass der pH-Wert den Säuregehalt angibt, ist das nicht richtig. Richtig ist, der pH-Wert gibt an, wie stark die Säure einer Lösung wirkt. Das Gleiche gilt für Laugen mit den pH-Werten zwischen 7 und 14.
- Der pH-Wert gibt demnach die Stärke der Wirkung von Säuren und Laugen an.
- Oder anders ausgedrückt: Der pH-Wert sagt aus, wie sauer bzw. alkalisch eine Flüssigkeit ist.
- Noch mal anders ausgedrückt beschreibt der pH-Wert die sauren bzw. alkalischen Eigenschaften einer Lösung.
- Der pH-Wert sagt nicht aus, wie viel Säure in der Lösung enthalten ist. Denn eine schwache Säure kann den gleichen pH-Wert haben wie eine stark ätzende Säure, die mit Wasser verdünnt wurde. Das Gleiche gilt für Laugen.
Wenn das verstanden ist, muss man noch etwas über die Werte wissen. Bei pH-Werten handelt es sich um sogenannte logarithmische Werte. Praktisch bedeutet das, dass eine Lösung mit dem pH-Wert 4 zehn Mal so sauer ist wie eine Lösung mit dem pH-Wert 5 usw. Bei den Laugen ist es umgekehrt. Wenn der Wert um 1 steigt, ist die Lösung zehn Mal ätzender als die Lösung mit dem niedrigeren Wert. Jeder Schritt in der logarithmischen Skala bedeutet eine Verzehnfachung - egal ob man nach unten in den sauren Bereich oder nach oben in den alkalischen Bereich (Laugen) geht. Anders ausgedrückt: Das Säurepotenzial steigt um das zehnfache, wenn der pH-Wert um 1 sinkt und das alkalische Potenzial steigt um das zehnfache, wenn der pH-Wert um 1 steigt. Wenn Sie beispielsweise zwei Flüssigkeiten mit den pH-Werten 2 und 6 vergleichen (4 pH-Stufen Unterscheid), dann ist der Unterschied eine 10.000-fach höhere Konzentration (10 x 10 x 10 x 10 = 10.000) von Säure.
Hier einige Beispiele von pH-Werten bei unterschiedlichen Stoffen:
Der pH-Wert wird mit einem Indikator festgestellt. Lackmus verändert seine Farbe in Abhängigkeit des pH-Wertes. So kann man mit einem Lackmuspapier den pH-Wert auf einer Farbskala ablesen.
- pH-Wert größer als 7 bedeutet alkalisch bzw. basisch
- pH-Wert = 7 bedeutet pH- neutral
- pH-Wert kleiner als 7 bedeutet sauer

Wenn das auch verstanden ist, sind Sie vielleicht noch nicht ganz sicher, was nun der Unterschied zwischen alkalisch, basisch und Lauge bedeutet. Immer wieder tauchen diese Begriffe auf und Sie haben vielleicht den Eindruck, dass immer das gleiche gemeint ist. Das ist auch (fast) richtig. Wenn es um die Einschätzung der Fähigkeiten von Reinigungsmitteln im Alltag geht, reicht es zu wissen, dass alkalische Reiniger eine Lauge erzeugen. Die Lösung ist basisch. Das bedeutet, der pH-Wert ist größer als 7 und maximal 14. Die Begriffe alkalisch, basisch und Lauge sind für Ihre Zwecke, also zur Beurteilung der Fähigkeiten von Reinigungsmitteln nahezu gleichbedeutend. Alkalisch und basisch bezieht sich auf die Eigenschaften der Lösung. Hier steht das Adjektiv im Vordergrund. Der Begriff Lauge als Substantiv bezeichnet meistens die Lösung an sich, ähnlich wie der Begriff „Putzwasser“. Manchmal ist damit auch ein Feststoff gemeint, der erst in Wasser aufgelöst werden muss. Danach ist die Flüssigkeit die Lauge.
Die Bedeutung des pH-Wertes für Reinigungsmittel
Wenn Sie beurteilen wollen, wozu sich en Reinigungsmittel gut eignet und wozu es sich nicht eignet, ist der pH-Wert die wichtigste Größe zur Orientierung.
Reinigungsmittel nach pH-Wert beurteilen – eine Faustregel:
- Saure Reinigungsmittel mit einem pH Wert unter 7 eignen sich z.B. zur Lösung von Kalk und werden meist als Badreiniger angeboten.
- Alkalische Reiniger mit einem pH-Wert über 7 eignen sich z.B. zur Lösung von Fett und organischen Verschmutzungen. Leicht alkalische Reiniger werden oft als Allzweckreiniger angeboten. Stark alkalische Reiniger werden als Abflussreiniger eingesetzt.
- Reinigungsmittel mit dem pH-Wert 7 nennt man Neutralreiniger. Auch solche Reiniger werden häufig als Allzweckreiniger bezeichnet.
Saure Reinigungsmittel mit einem pH-Wert unter 7
Mit sauren Reinigern entfernt man sogenannte anorganische bzw. mineralische Verschmutzungen. Saure Reinigungsmittel greifen Kalk, Urinstein und Rost an. Deshalb sind saure Reiniger der perfekte Helfer in Bad und WC. Aber auch Pigmente, Metallabrieb und Metallstaub können mit sauren Reinigern effektiv gelöst werden.
Bad-Reiniger enthalten immer Säure
Wegen der Fähigkeit der Säure, Kalk und Urinstein zu lösen, werden saure Reiniger meist als Badreiniger bzw. Sanitärreiniger bezeichnet. Diese Reiniger enthalten neben der Säure weitere reinigungsaktive Substanzen und unterschiedlich starke Säure. Denn Säure ist nicht gleich Säure. Es gibt stark ätzende Säuren und „sanftere“ Säuren in Reinigungsmitteln. Für die meisten Anwendungen in Bad und WC reichen die sanfteren Säuren wie Zitronensäure oder Amidosulfonsäure.
Vorsicht mit Essig, Essigsäure und Essigessenz
Viele Haushaltstipps beziehen sich auf die Reinigung mit Essig bzw. Essigsäure. Hier ist aber Vorsicht geboten. Essigsäure entwickelt reizende Dämpfe und greift Legierungen wie Messing an. Armaturen im Sanitärbereich und andere Gegenstände sollten deshalb nicht mit Essigsäure gereinigt werden.
Wozu sind saure Reiniger nicht geeignet?
Saure Reinigungsmittel lösen Kalk und unedle Metalle. Das bedeutet, dass diese Metalle und Kalk von Säuren angegriffen werden. Natursteine wie Marmor und Schiefer enthalten zum Beispiel Kalk und werden wie alle anderen Kalksteine durch Säure beschädigt. Die eingefressenen Zitronenflecken auf der Marmor-Küchenplatte sind ein Beispiel dafür. Wenn Sie solche Oberflächen mit sauren Reinigern behandeln, stumpfen diese unweigerlich ab, verfärben sich und es können je nach Säure auch Löcher entstehen. Auch Korkböden dürfen Sie nicht mit sauren Reinigungsmitteln behandeln. Außerdem sollten Sie darauf achten, dass Säuren nicht auf die Haut und auch nicht auf Ihre Kleidung gelangen. Tragen Sie deshalb beim Reinigen immer Putzhandschuhe.
Alkalische Reinigungsmittel mit einem pH-Wert über 7
Wenn man sich am pH-Wert orientiert, sind Laugen der „Gegenspieler“ von Säuren. Laugen sind genauso ätzend wie Säuren. Laugen greifen organische Verschmutzungen wie Fett, Eiweiß, Ruß, Algen und andere Ablagerungen aus der belebten Natur an. Im Gegensatz zu Säuren greifen Laugen aber keine Metalle an (außer Aluminium). Deshalb sind Laugen auch der ideale Abflussreiniger, Sie lösen die organischen Ablagerungen wie Haare auf, ohne die Abflussrohre anzugreifen. Der Haupteinsatzzweck von milderen Laugen ist aber die Fettlösung. Viele sogenannte Allzweckreiniger und Universalreiniger sind übrigens leicht alkalisch und damit auch Fette und Proteine gelöst werden können. Allzweck und Universal bedeutet in diesen Fällen immer, dass keine Kalklösung möglich ist. Einen WC-Reiniger benötigen Sie daher auch, wenn Sie einen solchen Universalreiniger haben. Auch Farben und Kleber können mit Laugen gut entfernt werden.
Die Alkalien, mit deren Hilfe Putzlaugen angemischt werden machen aus Allzweckreinigern, Schmierseife und aus Küchenreinigern starke Reinigungsmittel. Die Alkalien wirken wie ein Verstärker und erhöhen z.B. die Fettlösekraft erheblich. Das liegt auch daran, dass die reinigungsaktiven Substanzen wie Tenside bei einem hohen pH-Wert ihre Leistungsfähigkeit voll entfalten können. Zweitens haften die Alkalien fest am Schmutz. Dadurch stoßen sich die Alkalien zusammen mit dem festgehaltenen Schmutz von der zu reinigenden Oberfläche ab. Beim Spülen und Wischen wird der gelöste Schmutz daher leicht abtransportiert. Drittens sorgt der höhere pH-Wert dafür, dass sich die Moleküle von Fetten, Proteinen und Ölen aufspalten und lösen. Durch diese Mechanismen sind Laugen sehr effektiv.
Beim Wäschewaschen mit Vollwaschmitteln liegt der pH-Wert meist recht hoch bei pH 10 bis pH 11. Wie oben beschrieben können dadurch die enthaltenen Tenside optimal ihre Wirkung erzielen. Bei schonenden Waschmitteln wie Colorwaschmitteln oder Feinwaschmitteln ist der pH-Wert niedriger. Folglich ist die Reinigungsleitung entsprechend geringer.
Vorsicht beim Umgang mit Laugen
Wie bei den Säuren sind auch die Laugen unterschiedlich stark und reichen vom milden Waschsoda bis zum stark ätzenden Natriumhydroxid, welches man z.B. in Abflussreinigern und Backofenreinigern findet. Mildere Alkalien wie Soda werden zur Herstellung von Seifen und Waschmitteln verwendet.
 Da Laugen wie beschrieben die belebte Natur angreifen (Kohlenstoff-Verbindungen), gelten sie als stark gesundheitsschädlich. Schon in geringen Konzentrationen schädigen Sie Mikroorganismen und Fische. Auf der Haut sind Laugen besonders gefährlich. Mehr dazu finden Sie unter wie wirkt sich der pH-Wert auf der Haut aus. Auf vielen alkalischen Reinigern ist deshalb das Gefahrensymbol GHS 09 für Umweltgefährlich zu finden. Beachten Sie beim Umgang mit alkalischen Reinigungsmitteln unbedingt die angegebenen Schutzmaßnahmen und tragen Sie in jedem Fall Putzhandschuhe.
Da Laugen wie beschrieben die belebte Natur angreifen (Kohlenstoff-Verbindungen), gelten sie als stark gesundheitsschädlich. Schon in geringen Konzentrationen schädigen Sie Mikroorganismen und Fische. Auf der Haut sind Laugen besonders gefährlich. Mehr dazu finden Sie unter wie wirkt sich der pH-Wert auf der Haut aus. Auf vielen alkalischen Reinigern ist deshalb das Gefahrensymbol GHS 09 für Umweltgefährlich zu finden. Beachten Sie beim Umgang mit alkalischen Reinigungsmitteln unbedingt die angegebenen Schutzmaßnahmen und tragen Sie in jedem Fall Putzhandschuhe.
Neutralreiniger mit einem pH-Wert von ca. 7
Neuralreiniger gehören weder zu den sauren Reinigern noch zu den Laugen. Neutralreiniger reagieren neutral und gehören deshalb zu den Allzweckreinigern. Bei diesen Universalreinigern wirken vor allem die Tenside und die Emulgatoren. Meist ist eine mechanische Unterstützung beim Reinigen notwendig. Das kann z.B. Wischen, Schrubben, Hochdruckreinigen usw. sein.
Neutralreiniger haben viele Vorteile gegenüber den sauren und alkalischen Reinigern. Vor allem in Bezug auf die Umwelteigenschaften sind Neutralreiniger allen anderen Reinigern überlegen. Auch in Bezug auf den Arbeitsschutz und Hautkontakt sind diese milden Reiniger besser zu bewerten als die ätzenden Reiniger. Sie sind materialschonend und für empfindliche Oberflächen geeignet. Allzweckreiniger entfetten besser als saure Reiniger allerdings schlechter als alkalische Reiniger.
Neutralreiniger ist nicht immer neutral
Als neutral wird der pH-Wert 7 bezeichnet. Reines Wasser hat den pH-Wert 7. Kleine Abweichungen werden dennoch als neutral bezeichnet. Das gilt sowohl für das Wasser, welches auch nicht immer genau dem pH-Wert 7 entspricht als auch für die Neutralreiniger. Die pH-Werte von Neutralreinigern reichen von ca. 6 (leicht sauer) bis ca. 9, was einem leicht alkalischen Milieu entspricht. Die meisten Allzweckreiniger sind tatsächlich leicht alkalisch.
Wie reagiert unsre Haut auf die pH-Werte der Reinigungsmittel
Seit rund 140 Jahren ist bekannt, dass die Oberfläche der menschlichen Haut im leicht sauren Milieu liegt. Der pH-Wert der Hautoberfläche liegt meist zwischen 5,4 und 5,9. Im Zusammenspiel mit Schweiß, Talg, Hornzellen und den ebenfalls zur Hautflora gehörenden Bakterien ergeben sich durch diesen sogenannten Säureschutzmantel der Haut unterschiedliche Vorteile für den Menschen. Die Haut ist durch dieses leicht saure Milieu in der Lage, einige Keine und negative Umwelteinflüsse abzuwehren. So schützt uns die saure Hautflora vor manchen Infektionen. Reinigungsmittel wie Seife weisen einen alkalischen pH-Wert von über 7 auf. Dadurch wird das saure Milieu auf der Haut zerstört. Erst nach ca. zwei bis drei Stunden ist Der Säureschutzmantel wieder nachweisbar. Es wird daher empfohlen, insbesondere die Hände nicht zu oft mit alkalischen Handreinigern zu waschen.
Weitere Themen die Sie interessieren könnten:
-
- Die schmutzigsten Orte im Haushalt
- In diesem Tipp geht es beim Thema Schmutz um Bakterien. Genauer gesagt um schädliche Bakterien. Schlamm oder Finderabdrücke auf Glasscheiben und ähnliches sind hier also…

- mehr lesen…
-
- Hygiene-Regeln für die Küche
- Die „Bakterienzentrale“ jedes Haushaltes ist nicht die Toilette, sondern die Küche. Mehr dazu erfahren Sie auch unter die schmutzigsten Orte im Haushalt. In der…

- mehr lesen…
-
- Reinigung in Haushalt und Gebäuden
- Reinigungsprofis unterteilen Reinigungsarbeiten in drei Kategorien: Die Sichtreinigung, die Unterhaltsreinigung und die Grundreinigung. Sichtreinigung Die Sichtreinigung ist die…

- mehr lesen…
